ATOM MODELLERİ VE TARİHSEL SERÜVENİ
 dalton atom modeli: Atoma ilk bilimsel yaklaşımda bulunmuş.İçi dolu berk küreye benzetmiştir.
dalton atom modeli: Atoma ilk bilimsel yaklaşımda bulunmuş.İçi dolu berk küreye benzetmiştir.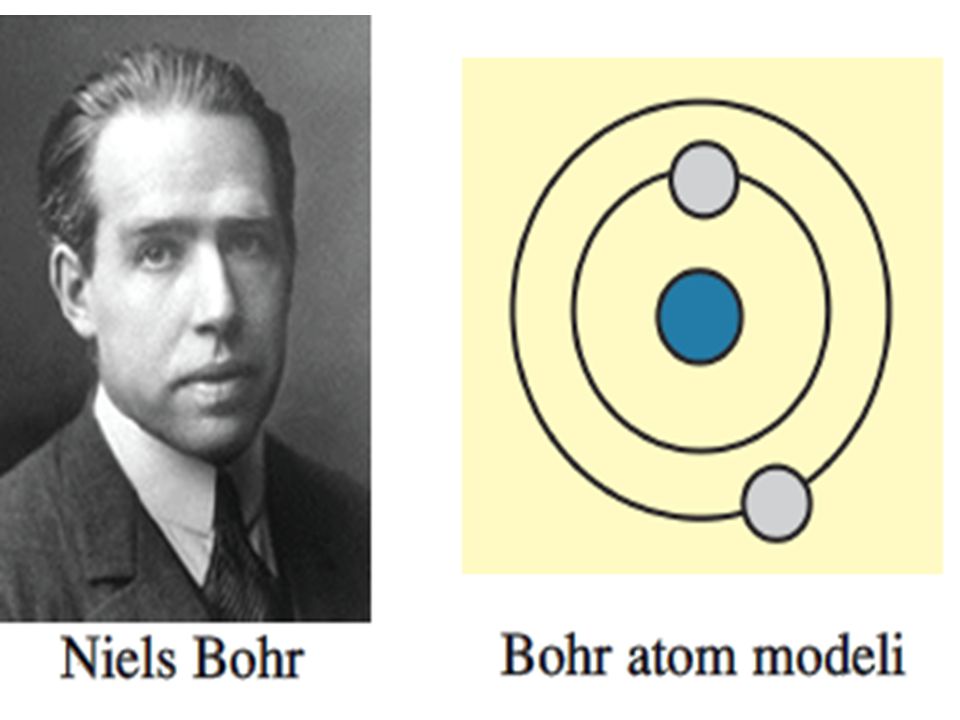 bohr atom modeli: Elektronların gelişi güzel dolanmadığını ve belli bir katman çevresinde dolandığını söylemiştir.
bohr atom modeli: Elektronların gelişi güzel dolanmadığını ve belli bir katman çevresinde dolandığını söylemiştir. james chadwick atom modeli: Protonların çekirdekte yalnız olmadığını,
james chadwick atom modeli: Protonların çekirdekte yalnız olmadığını,
burada yüksüz taneciklerin de (nötron) bulunduğunu keşfetmiştir
Çekirdekte,proton ve nötronlar bulunur.
ATOM VE ATOM ALTI PARÇACIKLAR
Atom: Maddenin en küçük yapı taşına denir.Atom iki kısımdan oluşur.
Çekirdekte,proton ve nötronlar bulunur.
Proton
* Atom çekirdeğinde bulunan pozitif (+) parçacıklardır.
* ''p'' ile gösterilir.
* Kütlesi yaklaşık nötronlar kadardır.
* Atomların kimliğini belirler ve atom numarası olarak bilinir.
* elektronlara göre hızı çok azdır.
* Atomun çekirdeğinde bulunan yüksüz parçacıklara denir.
* n harfi ile gösterilir.
*kütlesi yaklaşık protonlar kadardır.
* elektronlara göre hızı çok azdır.
Katmanlarda elektronlar bulunur.
* Katmanlarda bulunan negatif (-) yüklü parçacıklara denir.
* e harfi ile gösterilir.
* kütkesi proton ve nötronun yaklaşık 1/2000 kadardır.kütlesi en az olan parçacıktır.
* Atomdaki en hızlı parçacıktır.
*Atomun hacmini belirler.
***Proton sayıları eşit olan atomlar benzer özellik gösterir.
***Proton ve elektron sayısı birbirine eşit olan atomlara nötr atom denir.
* ''p'' ile gösterilir.
* Kütlesi yaklaşık nötronlar kadardır.
* Atomların kimliğini belirler ve atom numarası olarak bilinir.
* elektronlara göre hızı çok azdır.
Nötron
* Atomun çekirdeğinde bulunan yüksüz parçacıklara denir.
* n harfi ile gösterilir.
*kütlesi yaklaşık protonlar kadardır.
* elektronlara göre hızı çok azdır.
Katmanlarda elektronlar bulunur.
Elektron
* Katmanlarda bulunan negatif (-) yüklü parçacıklara denir.
* e harfi ile gösterilir.
* kütkesi proton ve nötronun yaklaşık 1/2000 kadardır.kütlesi en az olan parçacıktır.
* Atomdaki en hızlı parçacıktır.
*Atomun hacmini belirler.
***Proton sayıları eşit olan atomlar benzer özellik gösterir.
***Proton ve elektron sayısı birbirine eşit olan atomlara nötr atom denir.
Molekül:
Aynı veya farklı atomlar bir araya gelerek molekülleri oluştururlar. (moleküllere aynı veya farklı atomların oluşturdukları kümelerde diye biliriz.)
Hidrojen atomları bir araya gelerek hidrojen molekülünü oluşturmuştur.
Hidrojen ve oksijen atomları bir araya gelerek su moleküllerini oluşturur.
SAF MADDELER
Fiziksel yollarla kendisinden başka maddelere ayrışmayan madde saf maddedir.
Bir madde hangi büyüklükte olursa olsun atomlardan oluşur.Aynı cins atomların bir araya gelerek oluşturdukları saf maddeye element denir.
* elementler birer saf maddedir.
*Aynı cins atomlardan oluşurlar.
* Farklı elementlerin atomları birbirinden farklıdır.
*elementler sembollerle gösterilir.
Elementler doğada atomik yada moleküller halde bulunurlar.
Atomik:Aynı cins atomların doğada tek başına bulunmasına denir.
Element molekülü: Element atomlarının doğada gruplar halinde bulunmasına denir.
ilk 18 element sembolleri ve kullanım alanları
1 Hidrojen ( H ) Roket yakıtı olarak kullanılır. Ayrıca suyun yapısında bulunur.
2 Helyum (He) Zeplin ve balon şişirmede kullanılır.
3 Lityum (Li ) İlaçlarda, pil üretiminde, cam ve seramik yapımında kullanılır.
4 Berilyum Be Uçak ve uzay araçları yapımında elektrik ve ısı iletkeni olarak kullanılır.
5 Bor B Isıya dayanıklı cam yapımında ve roket yakıtında kullanılır.
6 Karbon C Kömür, petrol ve doğal gaz yapısında bulunur.
7 Azot N Tarımda gübre yapımında kullanılır.
8 Oksijen O Dalgıçlarda ve astronotlarda solunum için oksijen tüplerinde kullanılır
.
9 Flor F Diş macununun yapısında kullanılır.
10 Neon Ne Renkli reklam panolarında kullanılır.
11 Sodyum Na Kâğıt, gıda, tekstil ve sabunda kullanılır.
12 Magnezyum Mg Hava taşıtlarının yapısında kullanılır.
13 Alüminyum Al Mutfak araç gereçlerinde, elektrikli araçlarda ve içecek kutularında kullanılır.
14 Silisyum Si Camın yapısında kullanılır.
15 Fosfor P Suni gübre yapımında kullanılır.
16 Kükürt S Barut yapımında kullanılır.
17 Klor Cl İçme sularını dezenfekte etmek için kullanılır.
18 Argon Ar Ampullerde ve floresan lambalarda kullanılır.
Yaygın elementler ve sembolleri
Bileşikler:
En az iki farklı atomun belirli şartlarda bir araya gelerek oluşturdukları saf maddeye bileşik denir.
*Bileşikler belli bir oranda bir araya gelir.
*Yeni madde oluşur.
Su bileşiğinde, hidrojen ve oksijen olmak üzere iki farklı element vardır. Hidrojen elementi yanıcı bir gaz, oksijen elementi ise yakıcı bir gaz olmasına karşın oluşan su bileşiği, söndürücü sıvı özelliğine sahiptir.
Su bileşiğinin meydana gelmesi için 2 tane hidrojen atomu ile 1 tane oksijen atomunun bir araya
gelmesi gerekir
KARIŞIMLAR
Karışım: Birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelen maddelere karışım denir.
Karışımlar görünümlerine göre ikiye ayrılır:
1.Homojen Karışımlar:Karışımın her yerinde aynı özelliği gösteren ve dışarıdan bakıldığında tek bir madde gibi görünen karışımlara homojen karışım denir. Homojen karışımlar çözelti olarak ta bilinir.
Homojen karışımlara örnekler:
1. Hava
2.hazır limonata
3. Madeni para
4. Tuzlu su
5. Kolonya
Şekerli Su. Tuzlu Su ,Asitli Su, Bazlı Su, Çay, Kola ,Soda, Gazoz
2.Heterojen karışım: Dışarıdan bakıldığında tek bir madde gibi görünmeyen her yerinde aynı özelliği göstermeyen karışımlara heterojen karışım denir.
1.kuru yemiş
3.Ayran ve toprak
Demir tozu – Kükürt tozu , Su – Tebeşir tozu, Su – Kükürt tozu, Su – Yağ, Su – Benzin, Elma – Armut, Çamurlu su,Kum – Su, Kum – Çakıl,Su – Talaş, Toprak, Sis,Süt, Ayran,Su – Demir Tozu
çözünme:tuzun suyun içinde her tarafta aynı özelliği göstermesine çözünme denir.çözünme olayı çözeltiyi oluşturur.
çözücü: çözeltiler de madde miktarı çok olana çözücü denir. Bilgi;madde miktarı ne olursa olsun su olan çözeltiler de çözücüdür.
çözünen: çözeltiler de madde miktarı az olan maddelere denir.
Çözünme hızına etki eden faktörler
1. Çözünme hızına sıcaklığın etkisi:
Çay içerken dikkat etmişizdir çayımız sıcak iken şekerin çay içerisinde daha kolay çözündüğünü görmüşüzdür.
* Sıcaklık artıkça çözünme hızı artar.
*Sıcaklık azaldıkca çözünme hızı azalır.
yukarıdaki sıcaklıkları farklı sıvılardan sıcaklığı çok olanın (50) şekeri çözme hızı sıcaklığı az olandan (20) fazladır.
2. Çözünme hızına temas yüzeyinin etkisi:
Çözücü içinde çözünen maddenin yüzey alanı ne kadar küçük ise çözünme hızı o kadar çoktur.
Günlük hayatta hepimiz denemişizdir çayın içine atılan kesme şeker toz şekere göre daha geç çözünür.
bağımsız değişken: temas yüzeyi
bağımlı değişken: çözünme hızı
kontrollü değişken: sıvının sıcaklık
3. Çözünme hızına karıştırmanın etkisi:
Sıcaklıkları ve madde miktarları aynı olan çözeltilere konulan çözünen maddeyi karıştırma hızı artıkça çözünme hızı artar.
Sıcaklıkları farklı miktarı aynı olan çözücün içine şeker karıştırıldığında sıcaklığı çok olan çözücünün daha fazla şeker çözdüğü görülür.
bağımsız değişken : çözücünün sıcaklığı
bağımlı değişken : çözünme hızı (çözünen şeker mikrarı)
kontrol edilen değişken: çözücünün miktarı
yukarıdaki sıcaklıkları farklı sıvılardan sıcaklığı çok olanın (50) şekeri çözme hızı sıcaklığı az olandan (20) fazladır.
2. Çözünme hızına temas yüzeyinin etkisi:
Çözücü içinde çözünen maddenin yüzey alanı ne kadar küçük ise çözünme hızı o kadar çoktur.
Günlük hayatta hepimiz denemişizdir çayın içine atılan kesme şeker toz şekere göre daha geç çözünür.
bağımlı değişken: çözünme hızı
kontrollü değişken: sıvının sıcaklık
3. Çözünme hızına karıştırmanın etkisi:
Sıcaklıkları ve madde miktarları aynı olan çözeltilere konulan çözünen maddeyi karıştırma hızı artıkça çözünme hızı artar.
bağımsız değişken: karıştırma hızı
bağımlı değişken: çözünme hızı
kontrollü değişken: madde miktarı ve sıvının sıcaklığı
7. SINIF KARIŞIMLARI AYIRMA YÖNTEMLERİ
Daha önce karışımları homojen ve heterojen karışım olarak ayırmıştık şimdi bunları nasıl ayıracağımızı öğrenelim.
1. Eleme yöntemi : Farklı büyüklükteki heterojen katı tanecikleri ayırmada yöntemidir.
*Çakıl ve kumu ayırmada
*Un ve kepek
*ince kum - kalın kum
*kömür ve kömür tozu
*Ya da baklagil ve meyveleri büyük - küçük olarak ayırma eleme yöntemine örnektir.
2. Süzme Yöntemi: Katı tanecikler ile karışmış sıvıları ayırmada kullanılan yöntemdir.Süzme yöntemi katı-sıvı heterojen karışımları ayırmada kullanılır.
*Çay ile çay demini ayırma
*makarna ve su
* kumlu su
***süzme işlemi için süzgeç veya süzgeç kağıdı kullanılabilinir.
3. Mıknatıs yöntemi: Demir gibi mıknatısın çektiği karışımları ayırmada kullanılan yöntemdir.
*Demir tozu - şeker
* demir tozu -pirinç
*demir tozu- kükürt tozunu ayırma yöntemlerini ayırma mıknatısla ayırmaya örnektir.
4. Buharlaştırma Yöntemi: Homojen halindeki katı -sıvı çözümleri ayırmada kullanılan bir yöntemdir.Bu yöntemle çözücü olan olan su buharlaşır kapta geriye çözünen katı halde kalır.
* Tuzlu su
*süt tozu ile hazırlanan süt
* salça, reçel, pestil, pekmez hazırlamada buharlaştırma yöntemi kullanılır.
5.Damıtma Yöntemi: Homojen halindeki sıvı -sıvı karışımları kaynama noktalarından yararlanılarak ayrılırlar.Isıtılan sıvı -sıvı karışımlardan önce kaynama noktası küçük olan buharlaşır ve gaz hali sıvı hale getirilerek karışımlar birbirinden ayrılmış olur.
* Alkol ve su karışımı
* Kolonya
*petrolden ;benzin, mazot,gaz yağı, fuel oil, makine yağları ve asfalt elde edilmesi damıtmaya örnektir.
6. Yoğunluk farkı ile ayırma yöntemi : Birbiriyle karışmış olan tanecikler yüzdürme yada yoğunluğu birbirinden farklı sıvıları ayırma hunusini kullanarak ayırabiliriz.
*Samanla karışmış buğday
* sapla karışmış mercimek
* toprakla karışmış ıspanak
*su -yağ
*saman -buğday
*mercimek - talaş





























Hiç yorum yok:
Yorum Gönder